
結直腸癌(CRC)是高發(fā)惡性腫瘤,微衛(wèi)星穩(wěn)定型(MSS)CRC 占比超85%,對PD-1/PD-L1免疫檢查點抑制劑原發(fā)耐藥,核心原因是腫瘤微環(huán)境(TME)呈“冷腫瘤"特征——CD8?效應T細胞浸潤不足,髓系來源抑制細胞(MDSCs)、調節(jié)性T細胞(Treg)等免疫抑制細胞大量富集,形成免疫抑制屏障。
m?A甲基化是真核生物mRNA普遍的表觀轉錄修飾,YTHDF1作為關鍵m?A閱讀蛋白,可結合m?A修飾位點調控靶mRNA翻譯,在腫瘤發(fā)生發(fā)展中發(fā)揮重要作用,但YTHDF1在CRC免疫微環(huán)境重塑及MSS型CRC免疫治療耐藥中的具體機制尚未明確。本研究圍繞YTHDF1展開,旨在揭示其調控CRC免疫抑制的分子軸,并探索靶向YTHDF1聯(lián)合免疫治療的轉化潛力。

這是香港中文大學于君團隊發(fā)表在Gut(2023)的研究,核心結論:靶向m?A閱讀器YTHDF1可重塑結直腸癌(CRC)免疫微環(huán)境、增強CD8?T細胞殺傷、并與抗PD-1協(xié)同顯著提升療效,尤其可克服MSS型CRC的抗PD-1耐藥。
研究結果
(一)臨床相關性:YTHDF1是CRC免疫抑制標志物,高表達提示不良預后
1. 表達特征:TCGA、GEO公共數(shù)據(jù)集及408例CRC組織芯片(TMA)驗證,YTHDF1在CRC組織中顯著高表達,且表達水平與腫瘤分期、分級正相關。
2. 預后價值:YTHDF1高表達組患者總生存期(OS)、無病生存期(DFS)顯著縮短,是CRC獨立不良預后因素。
3. 免疫關聯(lián):TCGA免疫浸潤分析顯示,YTHDF1高表達與CD8?T細胞、IFN-γ、GZMB等效應T細胞特征負相關,與MDSCs、Treg等免疫抑制細胞特征正相關,證實YTHDF1是CRC“冷腫瘤"的標志性分子。

(二)功能驗證:YTHDF1調控CRC生長與抗腫瘤免疫
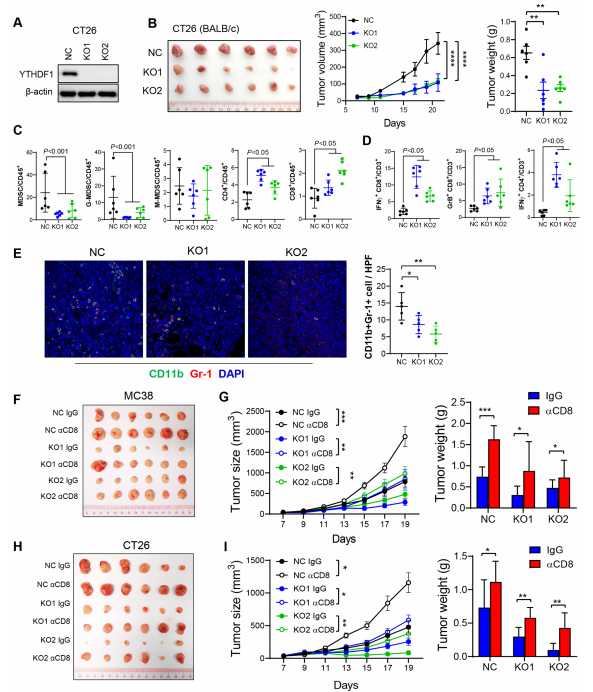
1. 敲除抑制腫瘤,激活抗腫瘤免疫:
① 在MSS型CT26、MSI-H型MC38 CRC小鼠模型中,shYTHDF1敲除顯著抑制腫瘤生長、延長小鼠生存期。
② 機制上,YTHDF1敲除后腫瘤內CD8?T細胞、IFN-γ?CD8?T、GZMB?CD8?T細胞浸潤顯著增加,MDSCs、Treg細胞顯著減少;IFN-γ、GZMB、TNF-α等抗腫瘤細胞因子mRNA水平升高。
③ CD8?T細胞耗竭實驗證實,YTHDF1敲除的抑瘤作用依賴CD8?效應T細胞。
2. 敲入加速腫瘤發(fā)生,構建免疫抑制微環(huán)境:
① 構建腸上皮特異性Ythdf1敲入(Ythdf1KI)小鼠,聯(lián)合AOM-DSS誘導CRC,結果顯示Ythdf1KI組腫瘤數(shù)量、大小顯著增加,CRC發(fā)生進程顯著加速。
② Ythdf1KI腫瘤中CD8?T細胞浸潤減少,MDSCs、Treg細胞增加,IFN-γ、GZMB表達降低;同時p65、CXCL1蛋白水平顯著升高,提示YTHDF1通過調控NF-κB/CXCL1軸參與免疫抑制。

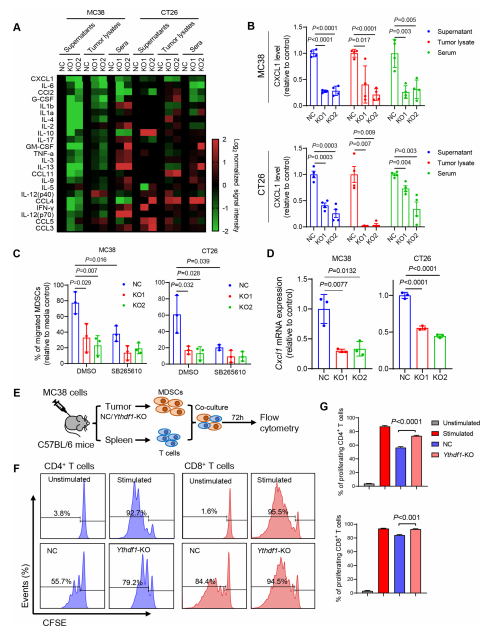
(三)分子機制:YTHDF1通過m?A-p65-CXCL1軸募集MDSCs,抑制CD8?T細胞
1. 核心調控軸:YTHDF1→m?A→p65翻譯→NF-κB激活→CXCL1上調:
① MeRIP-seq+Ribo-seq聯(lián)合分析發(fā)現(xiàn),YTHDF1敲除后p65(RELA)mRNA的m?A修飾水平下降,翻譯效率(TE)顯著降低,mRNA水平無明顯變化。
② RIP-qPCR證實YTHDF1直接結合p65 mRNA;雙熒光素酶報告實驗+點突變驗證,p65 mRNA 3'UTR的m?A位點是YTHDF1調控其翻譯的關鍵。
③ 功能實驗顯示,YTHDF1敲除導致p65蛋白水平下降,過表達則使p65蛋白水平升高;p65下游CXCL1、CXCL2、CXCL8等趨化因子的mRNA和蛋白水平均受YTHDF1正向調控。
2. 免疫抑制閉環(huán):CXCL1-CXCR2軸介導MDSCs募集,抑制CD8?T細胞:
① YTHDF1敲除可降低CXCL1分泌,減少MDSCs的體外遷移與體內浸潤;過表達YTHDF1則相反。
② CXCR2抑制劑(SB225002)可逆轉YTHDF1過表達誘導的MDSC募集;體內實驗中,CXCL1中和抗體或CXCR2抑制劑,能恢復YTHDF1過表達腫瘤中CD8?T細胞的浸潤與殺傷功能,抑制腫瘤生長。
③ 最終形成完整機制:YTHDF1→p65翻譯→NF-κB激活→CXCL1上調→CXCR2介導MDSCs募集→抑制CD8?T細胞。

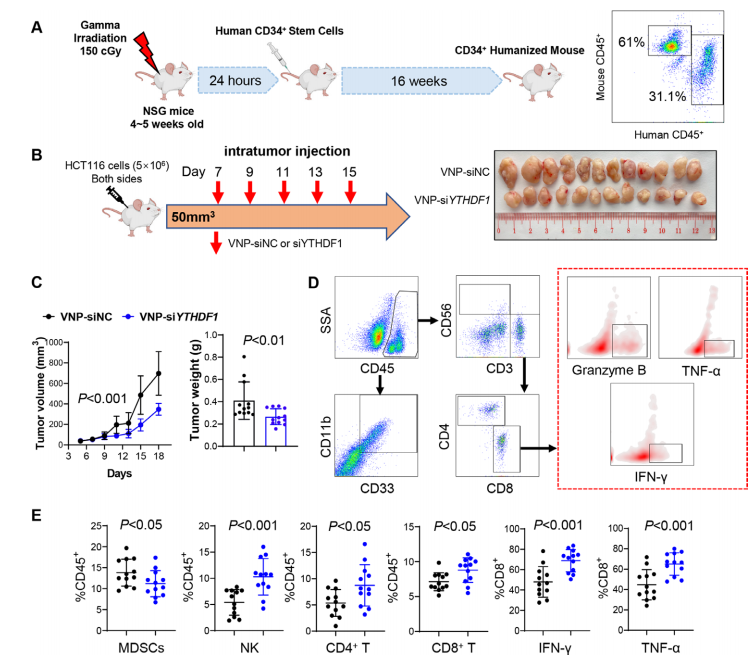
(四)轉化價值:靶向YTHDF1聯(lián)合抗PD-1逆轉MSS耐藥,VNP遞送系統(tǒng)具臨床潛力
1. 聯(lián)合免疫治療增效,逆轉MSS耐藥:
① MSS型CT26模型中,抗PD-1單藥幾乎無效,而siYTHDF1+抗PD-1聯(lián)合治療顯著抑制腫瘤生長,延長小鼠生存期;MSI-H型MC38模型中,聯(lián)合治療進一步增強抗PD-1單藥療效。
② 聯(lián)合組腫瘤內CD8?T細胞、IFN-γ?CD8?T、GZMB?CD8?T細胞顯著增加,MDSCs、Treg細胞顯著減少;IFN-γ、TNF-α、IL-2等抗腫瘤細胞因子升高,IL-10、TGF-β等免疫抑制細胞因子降低。
2. 靶向遞送系統(tǒng):VNP-siYTHDF1安全有效:
① 構建減毒沙門氏菌VNP包裹siYTHDF1(VNP-siYTHDF1),可靶向腫瘤微環(huán)境實現(xiàn)YTHDF1特異性敲低。
② CT26模型中,VNP-siYTHDF1單獨使用即可顯著抑瘤,聯(lián)合抗PD-1效果好;該遞送系統(tǒng)能有效降低腫瘤內YTHDF1、p65、CXCL1表達,增加CD8?T細胞浸潤、減少MDSCs。
③ 安全性評估顯示,VNP-siYTHDF1處理后小鼠體重無明顯下降,主要器官無明顯病理損傷,具備良好的臨床轉化安全性。
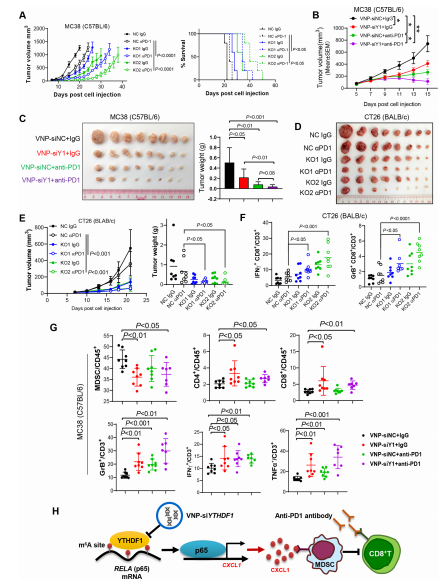
一句話總覽:YTHDF1高表達→通過m?A促進p65翻譯→激活NF-κB→上調CXCL1→募集MDSCs→抑制CD8?T→形成免疫抑制微環(huán)境→MSS-CRC抗PD-1耐藥;靶向YTHDF1(尤其VNP-siYTHDF1)可逆轉MDSC介導的免疫抑制,與抗PD-1協(xié)同增效,顯著抑制CRC生長。
研究意義
(一)理論意義
1. 明確YTHDF1是CRC免疫抑制的關鍵驅動因子,揭示了m?A表觀轉錄調控在腫瘤免疫微環(huán)境重塑中的新機制,完善了CRC免疫逃逸的分子網(wǎng)絡。
2. 闡明YTHDF1→m?A-p65→NF-κB-CXCL1→CXCR2-MDSCs的完整調控軸,為理解MSS型CRC免疫治療耐藥提供了全新的理論依據(jù)。
3. 證實YTHDF1可作為CRC預后評估與免疫治療療效預測的生物標志物,為CRC患者的分層管理提供新靶點。
(二)臨床轉化意義
1. 提出靶向YTHDF1聯(lián)合抗PD-1的新型聯(lián)合治療策略,為解決MSS型CRC免疫治療原發(fā)耐藥這一臨床難題提供了有效方案。
2. 開發(fā)的VNP-siYTHDF1靶向遞送系統(tǒng),實現(xiàn)了YTHDF1在腫瘤微環(huán)境中的特異性敲低,兼具高效性與安全性,為YTHDF1靶向藥物的臨床轉化奠定了基礎。
3. 本研究的機制發(fā)現(xiàn)可拓展至其他MSS型實體瘤,為泛癌種免疫治療耐藥的逆轉提供了新思路。